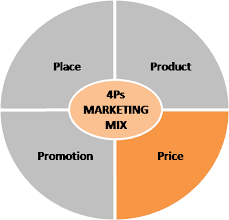
https://app.rmbr.in/5BBP01HBFpb 리멤버 커뮤니티 인사이트 연제- Pricing 편- [쉽고도 어려운 가격 정하기] 쉽고도 어려운 가격 정하기 앞서 [가격따위는 무시하는 마케팅]에서 명품들의 가격 정책에 영향을 주는 심리학적 이론들을 살펴 보았습니다. 마케팅 4P에서 가격이 차지하는 비중이 상당한 만큼 가격을 먼저 이야기나눈 후 app.rmbr.in 앞서 [가격따위는 무시하는 마케팅]에서 명품들의 가격 정책에 영향을 주는 심리학적 이론들을 살펴 보았습니다. 마케팅 4P에서 가격이 차지하는 비중이 상당한 만큼 가격을 먼저 이야기나눈 후 다른 3개의 P들을 이야기해보고자 합니다. "여러분들의 회사에서는 가격을 어떻게 결정하시나요?" 제품에 따라, 회사 방침에 따라, 정부 규제에 따라 ..