의료기기 인허가 제도 (시판 전 허가)
의료기기 인허가 관련 용어:
1. 동일제품군: 제조국, 제조사, 품목명이 동일한 의료기기 中 사용 목적, 사용방법, 제조방법이 동일. (단지 색상, 치수, 구성 부분품이 다른 것.)
A. 체외진단기기에서는 동일제품 사용 목적, 작용원리가 동일하면서 아래도 동일한 제품
- l 시약: 원재료, 성능
- l 진단장비: 시험규격 성능,
B. 개량제품: 기 허가(인증)된 기기와 사용목적, 작용원리, 원재료 같으나, 사용방법, 성능, 시험규격이 다른 것.
C. 새로운 제품: 기 허가(인증)된 기기와 사용목적, 작용원리, 원재료 등이 다른 것.
2. 일회용의료기기: 1 환자에게 1번 사용할 목적 OR 1번의 시술과정 (*검사과정)에서 1 환자에게 사용할 목적의 의료기기 (*일회용 체외진단의료기기)
3. 조합 의료기기: 2가지이상의 의료기기(*체외진단시약/장비)가 모여 하나의 의료기기가 되는 것. *조합체외진단의료기기
4. 한벌 구성의료기기: 2가지 이상의 의료기기(*체외진단의료기기)를 하나의 포장 단위로 구성. (예: 혈압측정기 + 당뇨측정기 세트), *조합체외진단의료기기
5. 일체형 체외진단의료기기: 체외진단 시약과 체외진단 장비의 제조사가 동일, 같은 사용 목적을 가지도록 설계`제조된 체외진단의료기기 (예: 당뇨측정기 + 진단시약가 한 세트로 구성된 제품)
6. 부분품: 의료기기 본체를 구상하기 위해 필요한 제품. (체외진단기에서는: 진약이나 장비와 같이 사용되는 것. 부분품 자체로는 의료기기 또는 체외진단의료기기가 아닌 것.)
*** 조합, 한벌, 일체형 의료기기의 정의가 혼동되니 그 차이를 인지하여 구분하여야 한다.
업허가:
구비서류: (1) 제조/수입업 허가 신청서, (2) 품질책임자 자격확인서류, (3) 대표자 건강진단서 (개인사업자의 경우): 25일 소요
업자의 경우 5가지로 구분: 의료기기 제조업자, 수입업자, 판매업자, 임대업자, 수리업자
제조/수입업자 (식약처장 허가)- 체외진단기기 제조/수입업자가 일반의료기 제조/수입 시의료기기 제조/수리업 허가 필요 [의료기기 수입/제조업자도 체외진단기기 업허가 별도필요 / 각각 필요]
수리업자, 판매업, 임대업자- 시장, 도지사, 군수, 구청장에 신고
l 제조/수입업자가 자기 제품을 판매/임대/수리하는 경우 별도의 신고 필요 없음.
l 판매업자 신고자는 임대업신고 필요 없음.
l 약국개설자, 의약품도매상- 판매/임대신고 필요 없음
l 수리의 경우: 중고의료기기 검사 필증의 발행 (시행규칙 27조 1항 15/33)
제조/수입업자: 품질책임자 필요- 제조소 마다 1인 이상 (단, 판매, 임대, 수리업자는 품질책임자 필요 없음). 의료기기와 체외진단의료기기를 모두 취급할 경우 1명의 품질책임자가 겸직가능.
l 품질책임자:
(1) 근무 시작일로부터 3개월 내 교육 이수 필요
(2) 1년에 8시간 의무 교육
(3) 품질책임자 교체 시 변경 허가 신청: 30일 내 - 품질관리자 규정 위반 시 300만원의 벌금
식약처에서 품질책임자에 대해 상당히 중요하게 생각하고 있어 이에 대해 자격, 교육, 역할을 인지해야 함.
l 판매/임대업: 관리책임자 필요
l 수리업자: 책임기술자 필요
제조업자의 조건부허가: 제조품질체계 KGMP를 갖추지 못한 경우 우선 조건부허가 받은 후 일정기간 내 시설을 갖춘 이후 이행신고를 하면 [조건부허가]를 [허가]로 바꿀 수 있다.
등급별 제조 또는 수입업 허가
l 의료기기 품목 분류 기준: 성능 발휘, 사용 목적 달성
l 의료기기 등급 분류 기준: 사용목적 및 인체에 미치는 잠재적 위해성
l 의료기기 4대 분류: (1) 기구/기계, (2) 의료용품, (3) 소프트웨어 (2020년 5월~), + (4) 치과재료
여전히 많은 제조/수입업자들이 Software를 의료기기로 인지하지 못하고 구성품 보다 낮게 보는 경향이 있어 제대로 허가등록을 하지 않는 경향이 강함. 많은 숫자의 영세 사업자의 경우 더욱 두드러지나 이는 오판임. Software를 의료기기로 인지하고 버전이 바뀔때 마다 필히 허가등록을 하여야 함.
의료기기 제조(수입) 신고 및 인증 처리 절차
1등급:
신고-수리 - 완료
2등급:
동일제품: 동일제품 입증 공문/ 식약처 제출: 신청- 5일이내 by NIDS (한국의료기기안전정보원)
동일제품이란? 기 허가/인증 제품과 사용목적, 작용원리, 원재료, 사용방법, 성능, 시험규격이 동일한 의료기기로 동일제조소에서 제조된 제품
|
제출서류
1. 기술문서 등 심사결과통지서 2. GMP적합인증서 3. (해당시) 위탁계약서 |
동등공고제품: 성적서/신청서 - 식약처 지정 시험검사 기관 제출 - 신청 - 5일이내 by NIDS (한국의료기기안전정보원)
동등공고제품이란? 2등급의료기기 (3~4등급은 해당 사항 없음!!!)중 동등제품으로 3회 이상 허가/인증 받은 제품에 대해 사용목적, 작용원리, 원재료, 사용방법 성능, 시험규격을 식약처 홈페이지에 공고한 의료기기
기술문서 심사필요 제품:
① 임상 불필요한 제품: 신청서/기술문서 - 식약처 지정 시험검사 기관 제출 - 신청/허가(5일이내) to NIDS (한국의료기기안전정보원)
② 임상 필요한 제품: 신청서/기술문서 - 신청/허가(80일이내) by MFDS (식약처), 임상필요제품: 유헬스케어기기, Contact Lens 등 허가 대상 의료기
- 2등급중 아래의 경우는 인증대상이 아님 (허가 필요)
① 의약품(의약외품)과 조합되거나 복합 구성된 의료기기
② 유헬스케어 의료기기: 원격의료용 기기가 해당
③ 추적관리 대상 의료기기 중 상시 착용하는 호흡감시기
④ 매일 착용하는 하드/소프트 콘택렌즈 (주의: 진단용 콘택렌즈는 해당하지 않음)
⑤ 의료기기 허가/신의료기술평가 통합운영 대상 기기
3~4등급:
1. 기 허가 제품과 비교하여 [동등비교], 자료 제출 범위를 확인- 동일제품허가: 증명서류 식약처 제출시 처리기간 10일
2. 기술문서 심사: 65일~80일
① 기술문서 심사 완료 기간: 55일 / 70일 (기술문서 심사 55일+ 임상자료 검토 15일 = 총 70일)
② 기술문서 심사 완료 후 허가 신청: 10일
3. 일괄 신청
① 기술문서 심사 (55일) + 허가 신청 (10일)= 65일: 임상시험자료 필요 없는 제품
② 기술문서 심사 (55일) + 임상자료 심사 (15일) + 허가 신청 (10일)= 80일: 임상 시험 자료가 필요한 경우
제조업의 허가: 식약처장이 제조업허가. 단, 다음의 사람은 제조업허가를 받을 수 없다
1. 정신질환자. (단, 전문의가 적합하다고 인정할 경우 가능)
2. 피성년후견인ㆍ피한정후견인 또는 파산선고를 받은 자로서 복권되지 아니한 자
3. 마약ㆍ대마ㆍ향정신성의약품 중독자
4. 의료기기법을 위반하여 금고 이상의 형을 선고받고 그 집행이 종료전 or 집행유예 확정 전인 자
5. 의료기기법을 위반하여 제조업허가가 취소 1년이 지나지 아니한 자
- 제조(수입) 업허가 구비 서류 / 업허가 처리기간: 25일 이내 (관할 지방식약청장에 서류 제출)
① 의료기기 제조(수입)허가신청서
② 품질책임자 자격 확인 서류
③ 대표자 건강진단서 (개인사업자만 해당, 발행일로부터 6개월이내)
- 제조/수입 업허가시 1개 이상의 신고, 인증, 허가를 동시에 제출해야 한다.
의약품 또는 의약외품과 의료기기가 조합되거나 복합 구성된 것으로서 그 주된 기능이 의약품 또는 의약외품에 해당하여 「약사법」 제31조제2항에 따라 이미 제조판매품목허가를 받거나 제조판매품목신고를 한 때에는 제2항에 따라 제조허가 또는 제조인증을 받거나 제조신고를 한 것으로 본다
허가가 취소된 의료기기와 사용목적, 작용원리 및 원재료 등이 동일한 의료기기로서 취소된 날부터 1년이 지나지 아니한 의료기기 제조허가 또는 제조인증을 받거나 제조신고를 할 수 없다.
신개발의료기기: 4~7년
l 품목의 제조허가일부터 4년 이상 7년 이하내 재심사 신청 (재심사 대상 의료기기의 제조업자)
l 4년 이상 7년 이하의 범위에서 식품의약품안전처장이 정하는 기간에 안/유조사(시판 후 조사)실시
제조 허가ㆍ신고 등의 사전 검토:
제조허가 또는 제조인증을 받거나 제조신고를 하려는 자와 임상시험을 하려는 자는 허가ㆍ인증ㆍ신고ㆍ승인 등에 필요한 자료에 대하여 미리 식품의약품안전처장에게 검토를 요청
제조업 변경 허가: 15일 이내 처리 요함
수입업허가: 식약처장 허가.
의약품 또는 의약외품과 의료기기가 조합되거나 복합 구성된 것으로서 그 주된 기능이 의약품 또는 의약외품에 해당하여 「약사법」에 따라 이미 수입품목허가를 받거나 수입품목신고를 한 때에는 제2항에 따라 수입허가 또는 수입인증을 받거나 수입신고를 한 것으로 본다.
수입업 변경 허가:
대표자명(상속에의한 대표자 변경 포함), 소재지, 업소명, 소재지, 품질책임자 변경 시 변경 허가 요함.
등급별 품목허가
- 의료기기 (체외진단의료기기) 신고/인증/허가 제품 대상
- 체외진단 의료기기: 사용목적과 개인+공중보건에 미치는 잠재적 위해성에 따라 4개 등급 분류
- 의료기기 사용 목적과 인체에 인체에 미치는 잠재적 위해성의 정도에 따라 4개 등급으로 분류
- 잠재적 위해성 기준:
① 인체 접촉 기간
② 침습정도
③ 약품/에너지 전달 여부
④ 생물학적 영향
| 1등급 잠재 위해성 거의 없는 |
2등급 잠재 위해성 낮은 |
3등급 잠재 위해성 중증도 |
4등급 위해성 고도 |
기타 | |
| 신고:NIDS | O (식약처장 고시제품) |
||||
| 인증: NIDS | O (식약처장 고시제품) |
||||
| 허가: MFDS | 1~2등급중 기 승인 제품과 동등하지 않은 제품 |
O 모든 3~4등급 제품 |
MDFS내 식품의약품 안전평가원 | ||
- 1등급: 기술문서 심사 면제 (본질적으로 동등하지 않은 의료기기는 기술문서 심사 대상)
- 2등급, 3등급, 4등급: 모두 기술문서 심사 대상
- 2등급, 3등급, 4등급 중 기술문서 심사 면제 대상은 아래와 같다.
- 동등공고제품: 2등급만 해당 / 2등급의료기기 중 원재료/ 작용원리/ 성능/ 시험규격/ 사용목적/ 사용방법이 동등한 제품: 기술문서심사면제
- 동일제품: 기 허가/인증 제품과 동일한 제품 (제조국, 제조사, 제조방법, 품목명, 원재료 (체외진단기기는 제외), 사용방법, 사용목적이 같고, 색상-치수-부분품이 변경/추가되는 제품)
- 수출만 목적으로 하는 의료기기
- 경미한 변경대상 의료기기
1등급(신고) 과 2등급(인증)은 NIDS (의료기기안전정보원)에서 진행
2등급 기술문서 심사의 경우 식약처 지정 기술문서심기관이 진행
1,2,3,4등급 허가는 모두 식약처가 전담
2등급만 동등공고, 기술문서: 식약처 지정 기술문서심사관…모든 허가는 식약처에서
신고, 인증, 허가 제한 대상:
- 허가가 취소된 의료기기와 사용목적/ 작용원리/ 원재료가 동일한 의료기기로 취소된 날로부터 1년 이내 제품
- 안전성/유효성에 문제가 있다고 식약처장이 지정한 원재료를 함유한 제품 (직간접으로 인체와 접촉되는)
- 수은: 국제수은협약이 적용되는 기기 (단, 치과용 캡슐형 아말감은 제외)
- 석면
- 프탈레이트 함유 수액세트: 디에틸헥실 프탈레이트, 디부틸 프탈레이트, 벤질부팅 프탈레이트
- 소해면상뇌증 (=광우병) 질병 감염 가능성 원재료 함유: 직간접 인체 접촉하며 식약처장이 지정한
- 분말 처리된 수술용 / 진료용 장갑
- 그 외 식약처장 고시
제품 명칭 문제 제품
① 의료기기 명칭으로 부적합. 다른 제품으로 오인 우려.
② 의료기기 적응증, 효능-효과를 그대로 표시
③ 그외 식약처장 고사
4. 체외진단의료기기도 동일한 기준 따름.
품목 인증/허가 프로세스: 필요 사항
- 품목: 시험검사 + 기술문서심사 + GMP심사
- 업: 업허가 (제조/수입)
- 품목허가+업허가+GMP (품질책임자 선임 + UDI 표준 코드 관리 책임자, 이는 품질책임자가 겸직 가능)
- 품목허가 및 GMP: 양도양수 시 양도양수 계약서 공증본 필요
의료기기 인허가 제도와 심사
심사의 종류:
① 제조/수입업 허가 ( & 변경허가)
② 제조/수입업 인증 (& 변경인증)
③ 제조/수입업 신고 (& 변경 신고)
④ 기술문서 심사 (변경심사):
- 4등급의 경우는 STED 심사 2014년 1월 1일부터 최조 허가 신청시 국제표준화 기술문서로 작성후 제출해야 한다. à 국제표준화기술문서 (STED: Summary Technical Documentation)
l 제조(수입) 업허가 구비 서류: 처리 기간 25일 (지방식약청장에 제출)
1) 의료기기 제조(수입)업 허가신청서 2) 품질책임자 자격 확인 서류 3) 대표자진단서 (개인사업자만)
l 제조(수입) 업 변경허가: 제출서류
1. 업소명변경: 법인 등기사항설명서 (개인: 사업자등록증) + 제조(수입)업 허가 사항 변경허가 신청서
2. 소재지변경 (추가): GMP적합인정서 + 위탁계약서 + 법인 등기사항설명서 (개인: 사업자등록증) + 제조(수입)업 허가 사항 변경허가 신청서
3. 품질책임자변경: 변경된 품질책임자 자격 확인 서류 + 제조(수입)업 허가 사항 변경허가 신청서
4. 양도양수 의한 변경: 법인등록번호가 다른업체로 양도양수, *대표자변경(or 다수대표자로), *법인-개인/개인-법인
- 제조(수입)업 허가 사항 변경허가 신청서
- 양도양수계약서
- 상속에 의한 “대표자” 변경일 경우: 가족관계증명서 (상속을 확인할 수 있는)
- 법인 등기사항설명서 (개인: 양수자 진단서 + 등록기준지 확인)
- 법인 내 대표자 변경: 제조(수입)업 허가 사항 변경허가 신청서 + 법인등기사항설명서
의료기기 기술 문서 & 국제표준화기술문서 (STED: Summary of Technical Documentation)
의료기기 규제 당국자 포럼 (IMDRF, International Medical Device Regulators Forum): 한글 작성 원칙
기술문서의 구성:
① 의료기기 심사의뢰서 (=허가/인증 신청서)
② 첨부자료
l 기 허가`인증 제품과 비교자료 ~~~등등등
국제표준화 기술문서 (4등급의 경우) 구성: STED
① 의료기기 허가 신청 내용 및 개요
② 첨부자료
허가 인증 신청서 항목:
| ① 명칭: 제품명, 품목명, 모델명 | 제품명2개 이상 기재 가능 제조(수입)업소명은 생략 가능 제품명 생략 시: 제조(수입)업소명, 품목명, 모델명 기재 *제품명은 기 허가된 제품과 같으면 안됨. 예외는 아래 1) 허가/인증취소와 동일의료기로 취소 후 1년 지난 경우 2) 동일 제조(수입)사가 취하 후 동일 제품 재 허가/인증/신고 3) 다른 업자가 병행수입 |
| ② 분류번호 (등급) | |
| ③ 모양 및 구조 | 1. 작용원리 - “사용목적”외 효능/효과가 표기되지 않도록 주의 2. 외형 3. 치수 4. 특성 |
| ④ 원재료 | ① 전기사용 않는 기구,기계, 의료용품, 치과재료: 일련번호, 부분품명칭, 원재료(성분명), 규격, 분량, 비고 (인체 접촉 여부 및 접촉 부위) l 비고란: 가교제, 가소제, 윤활제 등 기입 ② 전기사용 기구, 기계: 일련번호, 부분품명칭, 부품관리번호, 규격(특성), 수량, 비고 ③ S/W 단독: 일련번호, SW명칭, 버전/운영환경, 비고 |
| ② `제조 방법 | “제조원의 제조방법을 따른다” 라고 기재 멸균의료기기: 멸균방법 기재 ① 방사선멸균 (전자빔 포함): ISO 11137-1,2,3 ② 산화에틸렌멸균 (EO가스, Ethylene Oxide): ISO11135-1,2 ③ 습열멸균 (AutoClave: 고압증기멸균): ISO 17665-1,2,3 ④ 무균처리: ISO13408-1,2,3,4,5,6 ⑤ 기타멸균: ISO14971 동물유래 성분이 있는 경우 동물명칭, 원산국, 연령, 사용부위, 처리공정 *** 4등급의 경우 전체 공정 흐름도 기재 |
| ③ 성능 | 조합 의료기기: 조합된 기기 상태로 한벌구성 의료기기: 각각의 의료기기 별로 |
| ④ 사용 목적 | 조합 의료기기: 조합된 기기 상태로 한벌구성 의료기기: 각각의 의료기기 별로 |
| ⑤ 사용 방법 | ① 사용 전 준비 사항 ② 조작 방법 ③ 사용 후 보관 및 관리 방법 *** 일회용 의료기기: “재사용금지” 명확히 기재 *** 사용 전 준비 사항, 조작방법, 사용 후 보관 및 관리 방법 상세히 기록. 소비자가 직접 사용하는 경우 알기쉬운 용어로 기재. |
| ⑥ 사용 시 주의 사항 | |
| ⑦ 포장 단위 | 제조: 자사 포장 단위 수입: 제조원 포장 단위 |
| ⑧ 저장방법 및 사용기간 | 저장방법: 안정성 보장될 수 있는 보관조건 (온도/습도/차광) 및 유의사항 표기 다음의 경우 저장방법 + 사용기간(유효기간) 기재 ① 멸균의료기기 ② 시간에 따라 안전성, 성능변화 예측기기 |
| ③ 시험 규격 | 성능 시험규격 기재: 번호/ 시험항목/ 시험기준/ 시험방법 |
| ④ 제조원 (수입 또는 제조 공정 전부 위탁인 경우) |
제조국, 제조사명과 그 주소 (수입) |
| ⑤ 허가 조건 | |
| ⑥ 비고 |
첨부자료:
- 본질적 동등품목비교표
- 사용목적
- 작용원리: 작용기전, 작동원리// Catalog, 논문, 사용설명서(IFU, instruction for use) 등 1개 이상 제출
- 제품의 성능 및 안전을 확인하기 위한 자료
- 전기 기계적 안전에 관한 자료
- 시험성적서의 모델명은 반드시 허가 신청된 모델명과 일치해야 한다.
- 1. 식약처 지정 시험`검사기관 발급 시험성적서 (Test Report)
- 2. IEC가 운영하는 국제전기기기인증제도 (IECEE CB scheme) 공인시험기관(NCB)발행 시험성적서
- l IEC: International Electrotechnical Commission, 국제전기기술위원회
- l NCB: National Certification Body, 국제 공인 시험기관
- l CB Test Certificate상의 시험성적서 Ref.번호 = 시험성적서 Ref.번호 일치해야만 함.
- 3. 한국인정기구 인정 시험기관 발행 시험성적서
- 4. OECD 회원국 허가 공증 시험성적서
- 5. 국제시험기관인정협력채 인정 국제시험검사기관 발급 시험성적서
l 국내 표준전압, 표준주파수, 표준전원플러그
- l 표준전압: 110V, 220V, 380V
- l 표준주파수: 60Hz
- l 표준전원플러그: KS C 8305
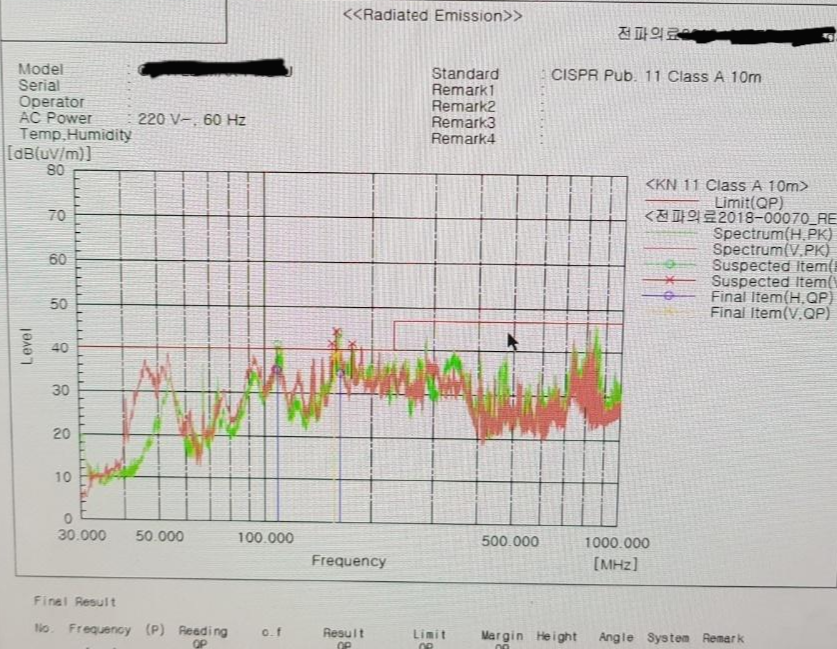
l 전자파 관련 안전 자료
l EMC Test: 전자파 적합성 시험 (Electro-Magnetic Compatibility)
- EMI: 전자파장해- 기기의 전자파가 다른기기에 성능에 영향 주지 않음 (내가 남에게)
- EMS: 전자파내성- 전자파가 가해지는 환경애서 성능 저하없이 동작 (남으로부터 내가)
l 임상시험에 관한 자료
- 1~2등급: 신청한 제품과 동등한 제품의 임상 시험 자료(논문/문헌) 제출 가능
- 식약처 지정 임상시험 기관에서 시험한 자료
- 외국자료로 실시 기관의 신뢰성이 인정되고 [의료기기임상시험관리기준]의해 실시자료
- OECD회원국에 허가 당시 제출되어 평가된 임상 자료 (공증)
- SCI나 SCIE에 등재된 전문학회지에 게재된 자료
허가 인증 신청서 항목: 체외진단 의료기기
| ① 명칭: 제품명, 품목명, 모델명 | |
| ② 분류번호 (등급) | |
| ③ 모양 및 구조 | 작용원리 외형(모양) 치수(중량) 특성 |
| ④ 원재료 | 일련번호, 명칭, 배합목적, 원재료명(성분명), 분량, 규격, 비고 |
| ⑤ 제조 방법 | “제조원의 제조방법을 따른다” 라고 기재. 멸균제조의 경우 멸균방법 기재 |
| ⑥ 성능 | 체외 진단 시약의 성능을 기재 분석적 성능시험 자료 1.분석적 민감도, 2. 분석적 특이도, 3. 정밀도, 4. 정확도 |
| ⑦ 사용 목적 | 조합 체외진단기: 조합형태로 일체형 체외진단기: 일체된 상태로 한벌 구성 체외진단기: 각각의 체외 진단 기기별로 목적 기재 |
| ⑧ 사용 방법 | 체외진단 시약 l 검체준비 및 저장 방법 l 검사 전 준비 사항 l 검사과정 l 결과판정 및 정도관리 체외진단 장비 l 사용 전 준비 사항 l 조작 방법 l 사용 후 보관 및 관리 방법 |
| ⑨ 사용 시 주의 사항 | “체외 진단용으로 사용해야 함.” 기재. |
| ⑩ 포장 단위 | |
| ⑪ 저장방법 및 사용기간 | |
| ⑫ 시험 규격 | |
| ⑬ 제조원 (수입 또는 제조 공정 전부 위탁인 경우) |
|
| ⑭ 허가 조건 | |
| ⑮ 비고 |
체외진단 소프트웨어 안전성 등급:
l A등급: 부상/신체피해 발생 가능성 없음.
l B등급: 경상 발생 가능성 있음
l C등급: 심각한 부상/사망 가능성 있음
위험관리시스템: ISO14971 - FMEA, Failure Mode & Effect Analysis Table (위험평가표)
위험 관리 실시 구성원
위험관리 계획
- 위험분석
- 위험평가
- 위험통제
- 잔여위험평가
- 전체 잔여 위험 허용 가능성 평가
생물학적 안전성 시험 요약
생물학적 안전성 시험의 시험성적서는
- 식약처장이 지정한 의료기기 비임상시험실시기관에서 비임상관리기준(GLP)에 따라 시험한 성적서
- OECD의 비임상관리기준에 의해 공인받은 기관에서 발급된 GLP자료
이면서 해당 제품과
- 동일한 원재료로 구성
- 인체 접촉 부위 및 접촉 시간이 동등하거나 그 이상인 제품임을 입증하는 자료제출
※ 피부에 24시간 이내 접촉하는 A품목의 경우 동일한 인체 접촉 시간 및 접촉 부위에 적용하는 동일한 원재료를 갖는 B품목의 성적서를 제출할 수 있다.
※ 피부에 24시간 이내 접촉하는 A품목의 경우 근육에 영구 이식되는 동일한 원재료를 갖는 C품목의 성적서를 제출할 수 있다.
임상시험 자료:
- 1등급 / 2등급: 동등제품에 대한 임상시험 자료 제출 가능.
- 3등급 / 4등급: 해당 제품에 대한 임상시험 자료를 제출해야 한다.






'한상진의 경영학 특강 > 품질경영과 의료기기 규제 과학' 카테고리의 다른 글
| [RA] 의료기기 규제과학전문가 - 제4장: 의료기기 임상 (0) | 2022.04.25 |
|---|---|
| [RA] 의료기기 규제과학전문가 - 제2장 4부: 시판 전 인허가 및 사후 관리 (0) | 2022.03.31 |
| [RA] 의료기기 규제과학전문가 - 제2장 3부: 시판 전 인허가 및 사후 관리 (0) | 2022.03.29 |
| [RA] 의료기기 규제과학전문가- 제2장 1부: 시판전 인허가 및 사후관리 (0) | 2022.01.17 |
| [RA] 의료기기 규제과학전문가- 제1장: 의료기기 규제과학 전문가 자격시험 (0) | 2022.01.10 |
